法规解读01丨法规监管动态
法规解读01丨法规监管动态
| 500 学员 |
| 学时: 5min |
| 课程数: 一节课 |
| 视频: 一个视频 |
| 色谱学堂 |
2015年下半年的制药行业可谓是血雨腥风,
CFDA不间断地颁发了一系列的准则和公告,
加强管理监督,频繁飞行检查,加重处罚力度,
这些规定犹如一个个炸弹砸落在新药申请的道路上。

有些企业抱着侥幸的心理想赶个末班车,
或者试试深浅,结果很不幸地撞到了枪口上。
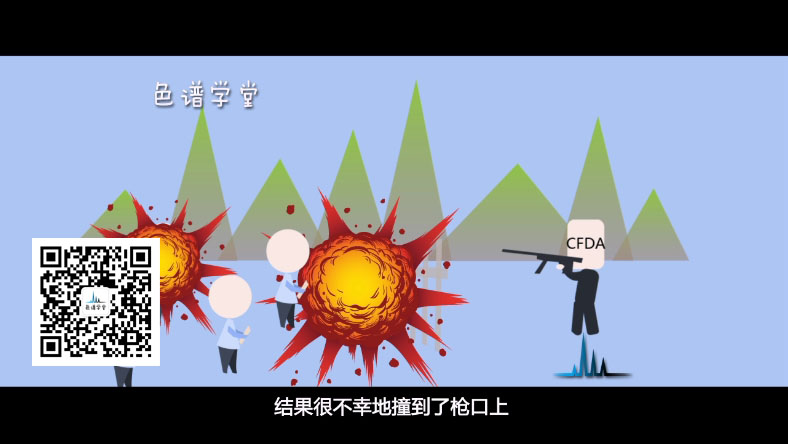
11月11日,CFDA发布关于8家企业11个药品注册申请不予批准的公告,
直接吊销GMP证书,此公告一出,大伙都吓呆了。
接下来的几个月里,
抱着侥幸心理想闯一闯的百余家企业
匆匆忙忙撤回了上千种药品注册的申请,
其他观望的企业也噤若寒蝉,整个行业充斥着焦躁与迷茫。

另一方面,行业内部也自发的兴起了研读CFDA公告的热潮,
个个都通宵达旦,废寝忘食,坐薪悬胆,手不释卷,
颇有当年高考的风范。
⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅♦ 试验数据存在的问题 ♦⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅
让我们先来看看阵亡的那批新药注册申请
在试验数据方面存在着哪些问题吧,
略微总结了一下,
主要包括原始记录缺失、分析测试系统无稽查轨迹、
修改调换、隐瞒弃用试验数据,分析测试过程不完整等。

可见,新法规对“数据完整性”提出了很高的要求。
那么问题来了,哪些数据需要合规呢?
为什么如此强调数据完整性呢?
⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅♦ 哪些数据需要合规 ♦⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅
众所周知,药物研发的生命周期十分漫长,
数据完整性是一个持续性的问题,
贯穿到从申报到生产的全过程。
QC实验室不用说,一定是要符合法规的,
但是研发的实验室就有些迷茫了,
我们需不需要符合法规呢?

研发实验室分两种,
一种叫做基础研究,
这一阶段处于病理研究以及活性化合物的寻找过程中,
这个阶段是不受控的,
大量的、繁琐的、个性化的研究手段无需遵循前面所提到的法规条例。

但是当活性药物成分从无数种化合物中被筛选出来,进入临床前研究,
后续的研究活动就必须进入法规遵循模式了。
或者说,与新药申报相关的研发数据都是受控的。
实际上,申报期间材料的完整性,那是更大风险控制的关键。
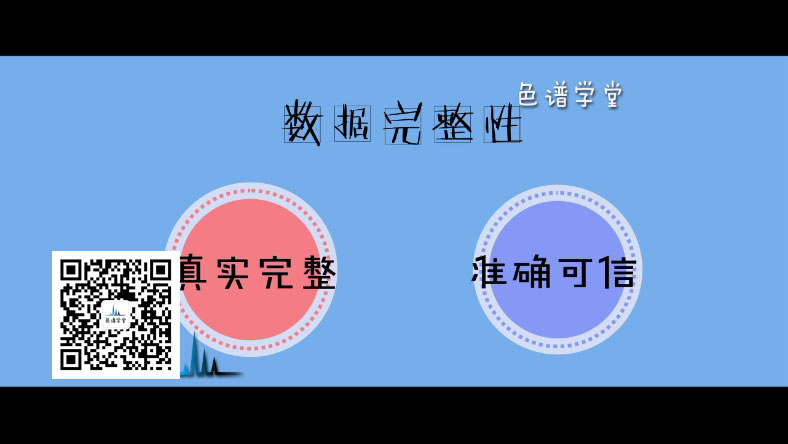
⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅♦ 为何强调数据完整性 ♦⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅
数据完整性包括了 真实完整、准确可信。
这是GMP的基本要求,本身并不是新的概念。
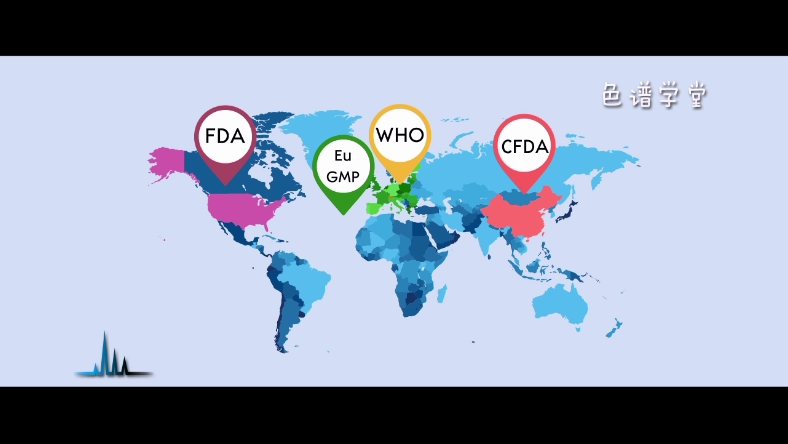
那为什么不仅是中国,世界上其它很多合规认证的机构和组织,
比如FDA、WHO、欧盟GMP等等,也都在强调数据完整性呢?
这是因为行业内现有的软件,
很多已经具备了成熟的审计追踪功能,
可以实现对数据篡改、覆盖和删除等风险进行追踪。
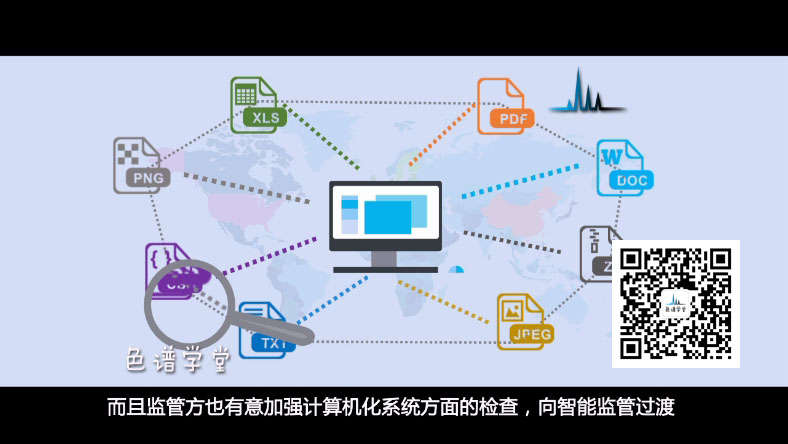
所以大量孤立的数据和记录联系起来形成信息流和数据链,
使得监管方更容易发现隐藏在数据后面的造假行为,
而且监管方也有意加强计算机化系统方面的检查,向智能监管过渡,
使得近期大量的电子数据完整性的问题被集中暴露出来。

对于做药品出口的企业来说,
电子数据合规是他们非常熟悉的内容,
因为FDA已经对此做了多年的规定。
而CFDA在2015年5月26日
也发布了新版GMP法规关于计算机化系统的附录,
并于2015年12月1日正式实施。

⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅♦ 新法规的要求 ♦⋅⋅⋅⋅⋅⋅⋅⋅⋅⋅
接下来,给大家解读的就是这个附录,
在这个附录里,明确提出了对计算机化系统验证的要求,
基于风险评估的验证方法学以及计算机系统合规性的功能要求。

法规内容并不多,一共24条,
和系统的基础架构、软件设置相关的大概是十余条。
为了保证数据的真实性和完整性,落实到软件的要求,
最重要的就是权限控制、审计追踪和数据版本可追溯。

具体附录都做了哪些规定呢?
下一集我们接着讲。

版权声明:本文版权属于色谱学堂(chromclass.com)所有,未经允许,禁止转载和摘编。如有需要,请联系market@chromclass.com 。
关于教员
购买过此产品并已登录的顾客才可发表评论。


目前还没有评论